Enlace covalente
Es el que aparece formando las biomoléculas, hace posible la enorme variedad de las mismas y les dota de ciertas propiedades que permiten comportamientos diversos de esas biomoléculas en el metabolismo celular. Los bioelementos primarios más abundantes, carbono, hidrógeno, oxígeno y nitrógeno, forman enlaces covalentes.
El enlace covalente se forma entre átomos cuya diferencia de electronegatividad es demasiado pequeña como para formar un enlace iónico, como ocurre entre los átomos de los elementos no metálicos. Éstos tienen su capa de valencia casi completa por lo que tienden a ganar electrones y no a cederlos, de manera que no pueden unirse entre sí para formar enlaces iónicos. Estos átomos en cambio comparten un par de electrones, uno procedente de cada átomo, en un orbital común (llamado orbital molecular) que forma el enlace.
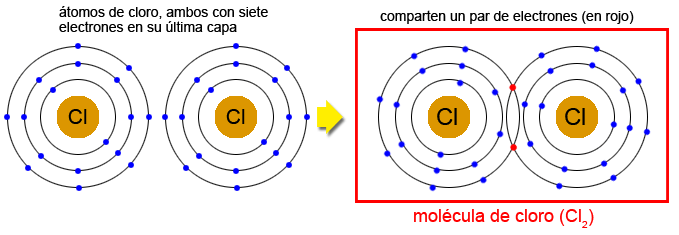 |
| Formación de un enlace covalente: molécula de cloro (cmm). |
El enlace covalente se puede formar entre átomos del mismo elemento químico o entre átomos de diferentes no metales. Cuando ocurre así, siempre hay una pequeña diferencia de electronegatividad entre esos átomos, lo que provoca que uno de ellos, el más electronegativo, atraíga con más fuerza los electrones compartidos y se establece cierta asimetría de carga haciendo que la molécula resultante se comporte como un dipolo. Así ocurre en el agua, en que el oxígeno atrae hacia sí los electrones y la molécula posee carga eléctrica dipolar haciendo que se establezcan fuerzas de atracción entre las moléculas de agua.
No siempre se comparte un único par de electrones formando un enlace sencillo. Si ambos átomos necesitan dos electrones para completar su última capa pueden compartir cuatro electrones formando un enlace doble, como ocurre en la molécula de oxígeno (O2). También es posible la formación de enlaces triples, compartiendo seis electrones, como enla molécula de nitrógeno (N2). Los enlaces cuádruples y quíntuples son infrecuentes y no se dan en la materia viva.
Propiedades de las sustancias covalentes en la materia viva
-
Hay sustancias polares o que poseen regiones polares que les permiten ser solubles en agua, como algunos azúcares (monosacáridos como la glucosa o disacáridos como la sacarosa).
-
Otras sustancias son fuertemente hidrófobas y repelen el agua, como muchos lípidos.
-
También hay sustancias cuya molécula posee ambas propiedades en regiones diferentes (son anfipáticas), como los fosfolípidos de la membrana celular.
-
Algunas se pueden ionizar en medio acuoso, como los aminoácidos.
Los enlaces del carbono
En el apartado dedicado a los bioelementos vimos que el carbono posee cuatro valencias y que puede formar enlaces simples, dobles y triples. La presencia de unos u otros tiene consecuencias muy importantes en las propiedades de las sustancias resultantes.
El enlace simple entre dos carbonos posee la peculiaridad de que permite el giro entre esos átomos (figura a en la ilustración siguiente) y, con ellos, los radicales a los que estén unidos. En cambio, la presencia de un enlace doble impide ese giro y da lugar a que la molécula pueda presentar dos conformaciones estructurales en función de la posición de los radicales unidos a los carbonos (b y c):
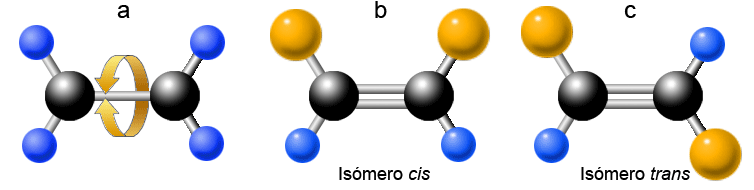 |
| a. Posibilidad de giro en torno a un enlace simple; b y c, isomería de doble enlace (cmm). |
Dos compuestos químicos con igual fórmula molecular pero diferente estructura y, en consecuencia, distintas propiedades se dice que son isómeros. En este caso se habla de isomería geométrica o cis-trans. En la ilustración anterior, las esferas azules representan átomos de hidrógeno y las esferas doradas representan otros radicales unidos a los carbonos que pueden ser desde simples grupos metilo -CH3 a sustituyentes más complejos y voluminosos. Es fácil entender que la posición de estos tendrá repercusión en las propiedades de la molécula. Así, la presencia de un doble enlace en posición central de la larga cadena hidrocarbonada de un ácido graso puede dar lugar a dos isómeros con forma y características muy diferentes:
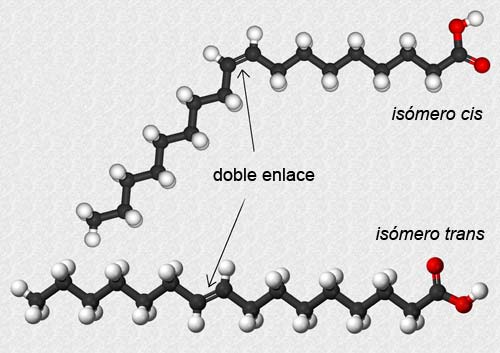 |
| By Alejandro Porto [CC BY-SA 3.0], via Wikimedia Commons |
Para saber más...
Puede que hayas oído hablar de la importancia de los ácidos grasos trans en la alimentación pero ¿qué son los ácidos grasos trans?
Como veremos más adelante, en el apartado dedicado a los lípidos, los ácidos grasos son biomoléculas de tipo lipídico que encontraremos formando parte de grasas y aceites, por ejemplo. Constan de largas cadenas hidrocarbonadas como las representadas en la ilustración anterior de isómeros cis y trans. Estas cadenas pueden contener únicamente enlaces simples entre los carbonos, y se habla de ácidos grasos saturados, o contener enlaces dobles y se llaman ácidos grasos insaturados.
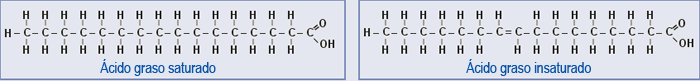
Los ácidos grasos saturados están presentes en grasas de origen animal (y algunas vegetales) y se relacionan con el colesterol asociado a lipoproteínas de baja densidad (LDL), lo que comúnmente se oye denominar "colesterol malo". En cambio, los insaturados y poliinsaturados, presentes en los aceites vegetales, tienen una influencia beneficiosa en la prevención de enfermedades coronarias, mentales, cáncer, diabetes, trastornos de la respuesta inmune y otros.
Los ácidos grasos insaturados, por tener algún doble enlace, poseen isómeros cis y trans. Los isómeros trans tienen los mismos efectos metabólicos que los saturados, por lo que se debería limitar su ingesta en la dieta. Los ácidos grasos insaturados naturales son mayoritariamente cis, pero es posible la isomerización en los no deseados isómeros trans por procesos como la hidrogenación industrial o el calentamiento durante el refinado o la fritura.
Entre el 1 y el 5% de los ácidos grasos trans que ingerimos proceden de alimentos como la leche y derivados o la carne y grasa de rumiantes. El 94 a 99% restante son de origen tecnológico, proceden de la transformación de ácidos grasos cis por hidrogenación (90%), desodorización (8%) y fritura (2%).
(Fuente: “El mundo de los lípidos”, por Isabel Carrero y Angel Herráez - sede web Biomodel![]() )
)
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
