RuBisCO, fotorrespiración y ruta C4
Mientras se dilucidaba el ciclo de Calvin, buena parte de la atención se centró en la enzima responsable de la carboxilación del RuBP. Pronto quedó patente que se trata de una proteína un tanto peculiar, porque puede promover tanto la carboxilación como la oxigenación del RuBP. Por esta razón, la enzima se conoce como RuBisCO, acrónimo de carboxilasa-oxigenasa del 1,5-bisfosfato de ribulosa. Cuando RuBisCO añade CO2 al RuBP se forman dos moléculas de PGA; pero cuando agrega O2 se forma una molécula de PGA y otra de un compuesto de dos carbonos, el fosfoglicolato:
El fosfoglicolato se transforma en glicolato, que algunas algas microscópicas excretan al medio. Pero generalmente el glicolato se recicla mediante una compleja red de reacciones en la que se hallan involucrados las mitocondrias, los peroxisomas y los propios cloroplastos. El proceso se denomina fotorrespiración porque consume O2 y genera CO2, aunque, a diferencia de la respiración mitocondrial, gasta energía en forma de ATP. De la ilustración siguiente se deduce que, como resultado neto, parte del carbono fijado por RuBisCO (empleado en regenerar el RuBP) se reoxida a CO2:
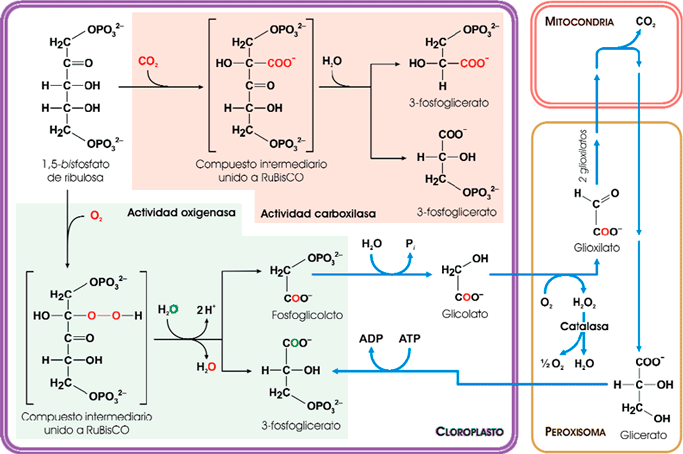
La fotorrespiración de las plantas (flechas gruesas de color azul) se debe a que RuBisCO, además de su actividad como carboxilasa, posee también actividad como oxigenasa (fuente ASH).
El O2 compite con el CO2 por el centro activo de RuBisCO, por lo que la utilización de una u otra molécula como sustrato dependerá de su concentración relativa. Dada la composición actual de la atmósfera, RuBisCO catalizará la oxigenación de la RuBP una de cada tres o cuatro veces. La fotorrespiración supone cierto alivio para lo que de otro modo sería un derroche en glicolato excretado, pero, aun así, sigue siendo despilfarradora para la economía energética del vegetal si se compara con una hipotética situación en la que RuBisCO funcionase mejor.
¿Por qué es tan “defectuosa”? La opinión más extendida es que la enzima se originó hace quizá 2500 millones de años, cuando apenas había O2 en la Tierra y, a cambio, abundaba el CO2 y no había presión selectiva para discriminar entre CO2 y O2. Al crecer la concentración de O2 y disminuir la de CO2 la selección natural, incapaz de diseñar una enzima nueva, se limitó a realizar ajustes en la vieja, restringiendo el acceso de su centro activo al O2; por desgracia, esto redujo también el acceso al CO2, y las plantas lo compensaron produciendo más cantidad de enzima: RuBisCO totaliza casi la mitad de las proteínas del cloroplasto y es la proteína más abundante en la Tierra. Cabe preguntarse qué ocurrirá dentro de 100 o 1000 millones de años, cuando el descenso en los niveles atmosféricos de CO2 —tras el breve repunte actual— haga definitivamente inviable la fotosíntesis basada en RuBisCO…
Entre tanto, ciertas plantas, como la caña de azúcar o el maíz, desarrollaron hace algunos millones de años un mecanismo para fijar CO2 que elude la fotorrespiración. Descrito en 1966 por el bioquímico australiano Marshall Davidson Hatch (n. 1932) y por el inglés Charles Roger Slack (n. 1937), incluye una enzima insensible al O2, pero que fija CO2 al fosfoenolpiruvato (un intermediario de la glucólisis) para dar oxalacetato (un intermediario del ciclo de Krebs). Es la primera reacción de la llamada ruta C4 (en referencia al número de átomos de carbono del oxalacetato) o ciclo de Hatch y Slack, que, como muestra la siguiente ilustración, eleva los niveles locales de CO2 en las hojas y favorece la actividad carboxilasa de RuBisCO:
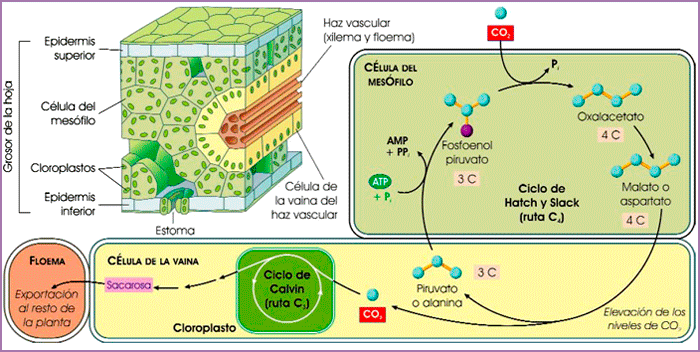
Corte transversal de la hoja de una planta con la ruta C4. Las células del mesófilo, próximas a los espacios aéreos de la hoja, fijan el CO2 y lo bombean a las células que rodean el tejido vascular donde se localiza RuBisCO (fuente ASH).
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
