4.5. Las dos "monedas" energéticas
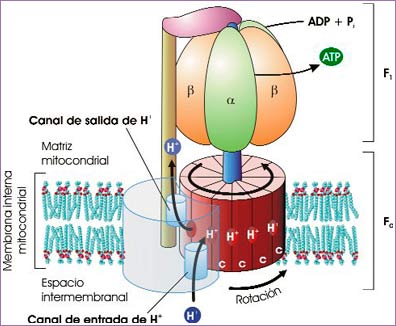
Modelo de la estructura de la sintasa del ATP. Por cada giro completo de la enzima se sintetizan 3 ATP (fuente: ASH).
En los últimos años se ha ahondado en la estructura y en el funcionamiento de la sintasa del ATP (véase la ilustración adjunta). Se trata, en esencia, de un rotor, que gira gracias a la libre difusión de protones a través de un anillo de proteínas llamadas subunidades c. Dicho anillo recuerda a una puerta giratoria: cuando un H+ entra a través de un determinado canal de entrada se une a una subunidad c, y esta unión hace que el anillo gire hasta que la siguiente subunidad c libre queda colocada frente al canal, dispuesta a recibir a un nuevo H+. Cada H+ ha de dar una vuelta completa para acceder a un canal de salida y ser liberado a la matriz mitocondrial. Este giro de 360º del anillo induce cambios conformacionales en el componente F1, responsables de la unión del ADP a la denominada subunidad β, su fosforilación y su liberación como ATP. Puesto que hay tres subunidades β, por cada giro completo de la sintasa se fabrican tres moléculas de ATP.
Se han contabilizado diez subunidades c en la ATPasa de levadura, lo que implicaría que han de atravesarla 10 H+ para que dé un giro completo y se formen 3 ATP. No obstante, es posible que el número de subunidades c varíe según el tipo de célula.
Por lo que respecta al motor eléctrico, se conoce bien el mecanismo de bombeo de protones del complejo III, algo menos el del complejo IV y muy poco el del complejo I. El complejo II —ya citado al hablar del rendimiento del ciclo de Krebs— no bombea H+, como tampoco lo hacen otras deshidrogenasas que pasan electrones a la coenzima Q (por ejemplo, la ETF que interviene en la β-oxidación). Las medidas más ajustadas muestran que, por cada par de electrones que lo atraviesan, el complejo I bombea 4 H+, el complejo III bombea otros 4 H+ y el complejo IV bombea 2 H+. En total, 10 H+ por cada NADH que cede sus electrones, y 6 H+ si se ceden directamente a la coenzima Q.
Estos datos parecen indicar que se generan 3 ATP por cada NADH que cede sus electrones a la cadena respiratoria. No obstante, dos circunstancias pueden alterar este cálculo:
- El complejo I solo recoge los electrones del NADH si este se halla en la matriz mitocondrial. Por tanto, el NADH generado en la glucólisis no podría en principio ser reoxidado por la cadena respiratoria, ya que se produce en el citosol y la membrana mitocondrial interna es impermeable al NADH. Sin embargo, las mitocondrias de las células animales poseen sistemas de lanzadera que transportan electrones desde el NADH citosólico a la cadena respiratoria por una vía indirecta. La más activa de ellas, llamada lanzadera del malato-aspartato, transfiere electrones desde el NADH citosólico a una molécula de NAD+ de la matriz, que se reduce a NADH y cede luego sus electrones al complejo I; pero la lanzadera del glicerol 3-fosfato, propia del músculo esquelético y del cerebro, pasa electrones directamente a la ubiquinona, «saltándose» el complejo I, por lo que solo se bombearán 6 H+.
En las plantas no hay necesidad de sistemas de lanzadera, puesto que sus mitocondrias incluyen una deshidrogenasa orientada hacia el citosol que transfiere electrones directamente desde el NADH de origen glucolítico a la ubiquinona, eludiendo el complejo I y bombeando, pues, 6 H+.
- El gradiente de H+ no se utiliza únicamente para fabricar ATP. Muchos transportadores que operan en la membrana mitocondrial interna obtienen directamente su energía del gradiente de H+ (véase la ilustración siguiente), y no del ATP. Es el caso de los transportadores que han de introducir en la matriz mitocondrial las moléculas de fosfato y de ADP necesarias para la síntesis de ATP, al tiempo que dejan salir el ATP recién formado. Uno de tales sistemas, por ejemplo, promueve el cotransporte de una molécula de Pi y de un H+; como cada ATP sintetizado implica el consumo de un Pi, la síntesis de 3 ATP precisará, en realidad, del flujo de 13 H+ (10 para completar una vuelta del rotor y 3 para obtener los correspondientes Pi).
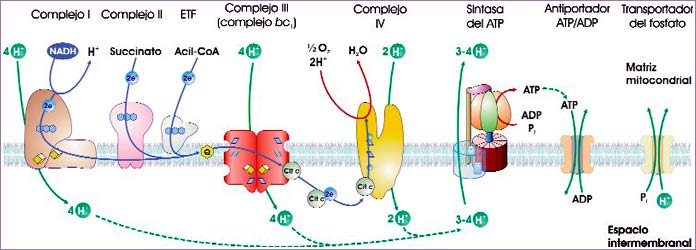
Esquema del acoplamiento entre el flujo de electrones a través de la cadena respiratoria y la síntesis de ATP (fuente: ASH).
Abundando en el último punto, cabe destacar que cada día se descubren más procesos celulares cuya fuente de energía no es la hidrólisis de ATP, sino el flujo de iones H+ a favor del gradiente de concentración: abarcan desde el intercambio de moléculas o iones a través de membranas hasta reacciones de biosíntesis, pasando por el movimiento de los flagelos bacterianos y la generación de calor. En muchas ocasiones el gradiente de H+ es sustituido por un gradiente de iones Na+: se conocen, por ejemplo, sintasas de ATP impulsadas por un flujo de dichos iones sodio.
Contemplar al ATP como la moneda energética de las células era, sin duda, una visión correcta en tiempos de Lipmann, pero tras la admisión de la hipótesis quimiosmótica adolece de falta de actualización. En realidad, todas las células conocidas disponen de dos monedas energéticas, una soluble —el ATP o, a veces, el GTP— y otra asociada a membranas —el gradiente de protones y/o de iones sodio— La sintasa del ATP actúa como oficina de cambio, capaz de convertir una moneda en la otra. Y su cotización, como ocurre con las divisas de los distintos países, fluctuará en función de los avatares de la economía (es decir, de la energética) celular.
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
