4.3. La cadena respiratoria
A partir del descubrimiento de la función de las mitocondrias se empezaron a conocer más y más detalles sobre la cadena respiratoria insertada en su membrana interna. En primer lugar, se identificaron la mayor parte de sus componentes:
- NAD (dinucleótido de nicotinamida y adenina), FAD (dinucleótido de flavina y adenina) y FMN (mononucleótido de flavina). Estas conocidas moléculas transportadoras no solo suministran electrones a la cadena respiratoria, sino que también se asocian a proteínas de la membrana interna y actúan como transportadores intermediarios de electrones.
- Citocromos. A los citocromos clásicos (a, a3, b y c) se les unieron pronto otros que se iban descubriendo a medida que se perfeccionaban las técnicas. Así, se observó en 1955 que la banda de absorción inicialmente adscrita al citocromo c derivaba, en realidad, de dos componentes: uno el citocromo c propiamente dicho, y otro una molécula a la que se denominó citocromo c1.
-
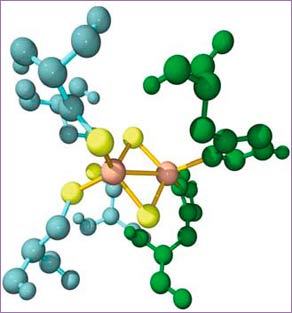 Centros ferrosulfurados (o centros FeS). Se trata de grupos prostéticos sin anillo de porfirina, formados por átomos de hierro unidos a átomos de azufre inorgánico y a otros átomos de azufre de las cadenas laterales de los aminoácidos de la proteína a la que pertenecen. Con una excepción, estos centros actúan siempre transfiriendo electrones —a través de sus átomos de hierro, que experimentan transiciones Fe3+ / Fe2+— desde el FAD o el FMN (que a su vez los recoge del NAD o de intermediarios del ciclo de Krebs o de la β- oxidación) hasta la ubiquinona. La excepción es el llamado centro Rieske, que “trabaja” junto a los citocromos b y c1 (ilustración derecha).
Centros ferrosulfurados (o centros FeS). Se trata de grupos prostéticos sin anillo de porfirina, formados por átomos de hierro unidos a átomos de azufre inorgánico y a otros átomos de azufre de las cadenas laterales de los aminoácidos de la proteína a la que pertenecen. Con una excepción, estos centros actúan siempre transfiriendo electrones —a través de sus átomos de hierro, que experimentan transiciones Fe3+ / Fe2+— desde el FAD o el FMN (que a su vez los recoge del NAD o de intermediarios del ciclo de Krebs o de la β- oxidación) hasta la ubiquinona. La excepción es el llamado centro Rieske, que “trabaja” junto a los citocromos b y c1 (ilustración derecha).Centro Rieske unido a aminoácidos (azul y verde). Los átomos de azufre están en amarillo, y los de hierro en color salmón (fuente: ASH).
- Ubiquinona o coenzima Q. Es el único transportador de electrones que no forma parte de proteínas, y se mueve con libertad por la bicapa fosfolipídica de la membrana interna mitocondrial. Como se ha mencionado con anterioridad, la ubiquinona (Q) acepta dos electrones y dos protones, convirtiéndose en su forma reducida ubiquinol (QH2), y luego los cede y se oxida de nuevo (ilustración siguiente).
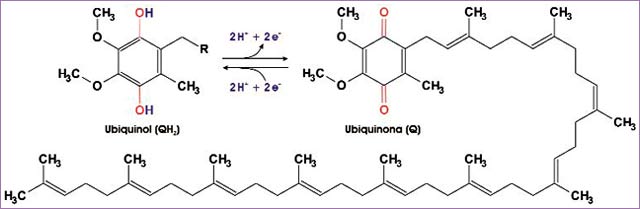
La coenzima Q en su forma reducida (ubiquinol) y oxidada (ubiquinona). La larga cola hidrocarbonada (representada en el ubiquinol por una R) es la responsable de que la molécula sea soluble en la bicapa fosfolipídica de la membrana mitocondrial interna (fuente: ASH).
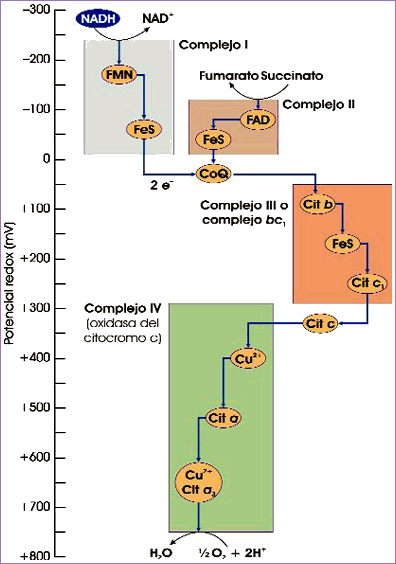
“Escalera” de electrones que fluyen gradualmente desde el NADH o el succinato hasta el O2. FeS simboliza un centro ferrosulfurado, CoQ la ubiquinona y cit quiere decir citocromo (fuente: ASH).
Al mismo tiempo se iba haciendo patente que todos estos transportadores de electrones no se encontraban aislados en la membrana interna mitocondrial, sino que formaban agrupaciones a las que se denominó complejos I, II, III y IV (este último se correspondía con la citocromo oxidasa). Los únicos miembros de la cadena respiratoria que no formaban parte de estos complejos, al menos no de forma permanente, eran la coenzima Q (que se difundía por la bicapa lipídica) y el citocromo c (que se halla en el espacio intermembranal transportando electrones desde el complejo III hasta el IV). En la ilustración de la derecha se muestra la composición de estos complejos y sus “entradas” y “salidas” de electrones.
De fundamental importancia es un detalle que puede apreciarse en la citada ilustración. Los electrones, como ya se ha comentado en varias ocasiones, fluyen gradualmente desde un transportador a otro con un potencial redox algo más positivo, como si bajaran por una escalera en lugar de saltar por la ventana. Sin embargo, en los complejos I, III y IV el “salto” es lo suficientemente elevado como para que se desprenda la energía necesaria para sintetizar ATP (en el complejo IV se trata de un gran salto).
Ahora bien, ¿cómo tiene lugar el acoplamiento entre la oxidación del NADH y la síntesis de ATP? Durante un tiempo se pensó en un mecanismo similar al de la fosforilación a nivel de sustrato; es decir, en los complejos I, III y IV se debería formar un compuesto de elevada energía desde el que se transfiriera un grupo fosforilo al ADP. Pero ese intermediario, pese a una intensiva búsqueda, nunca fue hallado.
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
