Propiedades de los aminoácidos
Las características estructurales y químicas de los aminoácidos son responsables de sus propiedades, entre las que destacan las siguientes:
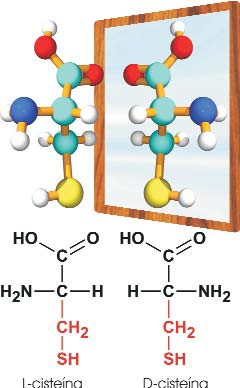 Estereoisomería. El carácter asimétrico del carbono α origina dos isómeros espaciales. Por convención, si en una fórmula plana se escribe el grupo carboxilo y la cadena lateral R hacia arriba y abajo del carbono α, respectivamente, entonces el grupo NH2 se representará a la derecha en el estereoisómero D, y a la izquierda en el L. Los aminoácidos de las proteínas son todos del tipo L, aunque existen excepciones en pequeñas proteínas de la pared bacteriana.
Estereoisomería. El carácter asimétrico del carbono α origina dos isómeros espaciales. Por convención, si en una fórmula plana se escribe el grupo carboxilo y la cadena lateral R hacia arriba y abajo del carbono α, respectivamente, entonces el grupo NH2 se representará a la derecha en el estereoisómero D, y a la izquierda en el L. Los aminoácidos de las proteínas son todos del tipo L, aunque existen excepciones en pequeñas proteínas de la pared bacteriana.
De los 21 o 22 aminoácidos proteinogénicos no presentan isomería espacial la glicina (Gly), que carece de carbono asimétrico, y la prolina (Pro), que no responde a la fórmula general del resto de aminoácidos, ya que su cadena lateral alifática (–CH2–CH2–CH3) se cicla uniéndose al grupo amino.
- Actividad óptica. Excepto la glicina (Gly), que no posee un carbono α asimétrico, el resto de los aminoácidos son capaces de desviar el plano de la luz polarizada hacia la derecha (dextrógiros, +) o hacia la izquierda (levógiros, –). Al igual que ocurre con los monosacáridos, no existe una relación directa entre las formas espaciales D y L y la actividad óptica: un L-aminoácido podrá ser dextrógiro o levógiro, y lo mismo sucede con los D-aminoácidos.
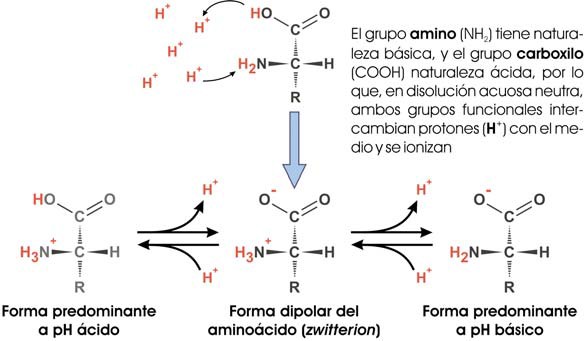
- Carácter anfótero. Una molécula es anfótera si puede actuar como ácido o como base, dependiendo del pH del medio. Un aminoácido, al poseer un grupo –COOH, presenta carácter ácido y puede ceder un H+, pero, al mismo tiempo, la presencia de un grupo amino (–NH2), le confiere carácter básico y le permite aceptar un H+.
Así, los grupos –COOH y –NH2 estarán ionizados (–COO¯ y –NH3+) a pH fisiológico (7,4), y los aminoácidos aparecerán como iones dobles o zwitteriones (véase la ilustración a continuación); a pH ácido tendrán carga neta positiva, ya que el –COO¯ captará un H+ y se convertirá en –COOH; y a pH básico tendrán carga negativa, al convertirse el grupo –NH3+ en –NH2. No obstante, las cadenas laterales de algunos aminoácidos pueden ceder o captar H+, lo que alterará su carga neta. El pH para el cual un aminoácido tiene carga neta cero se llama punto isoeléctrico, y dependerá de cuál sea su cadena lateral.
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
