2. Las enzimas
Todas las células necesitan obtener energía química a partir de la captación de energía solar o degradando nutrientes ricos en energía, convertir las moléculas nutrientes en las biomoléculas propias de la célula (proteínas, polisacáridos…) y sintetizar y degradar moléculas requeridas en funciones especializadas, como pigmentos o mensajeros celulares. En estos procesos participan miles de reacciones químicas que tienen lugar en las células, y cuyo conjunto se conoce como metabolismo (del griego metá, “más allá de”, bol, “lanzar”, e -ismos, “proceso”).
Una característica común a todas las reacciones metabólicas es que tienden a transcurrir con gran lentitud, incluso aunque estén termodinámicamente favorecidas —esto es, aunque los productos de la reacción (P) posean una energía libre inferior a la de los reactantes o sustratos (S)—. Ello se debe a que, para que la reacción culmine en cualquiera de los dos sentidos (S → P o P → S), es necesario alinear grupos químicos, reordenar enlaces, formar cargas eléctricas efímeras y llevar a cabo otras transformaciones que demandan una cantidad de energía, conocida como energía de activación, usualmente muy superior a la energía libre de los reactantes o de los productos. Es como si entre unos y otros se interpusiese una “colina” de energía, a cuya cima deben “trepar” las moléculas y formar un estado de transición en el que la formación y ruptura de enlaces haya llegado a un punto tal que la “caída” hacia el estado estable S o P sea igualmente probable:
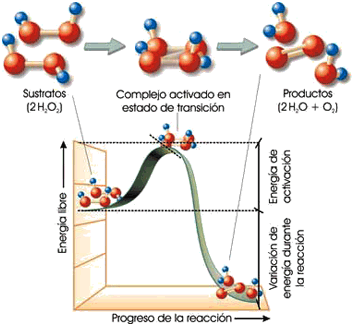
La descomposición de peróxido de hidrógeno (H2O2) para formar agua (H2O) y oxígeno (O2) está favorecida energéticamente, puesto que la reacción libera unos 117 kJ mol–1 de energía libre. Sin embargo, para ello los reactantes o sustratos han de “superar” una elevada barrera de energía (de unos 75 kJ mol–1) necesaria para que se rompan los antiguos enlaces y se formen otros nuevos en el estado de transición. (Fuente: ASH)
En una población de trillones o cuatrillones de moléculas de sustrato idénticas, solo unas pocas tendrán una energía superior a la energía de activación. En consecuencia, el número de moléculas que reaccionarán por unidad de tiempo será pequeño, y la velocidad de la reacción será baja. Gracias a ello, es improbable que la glucosa de nuestras células se combine con O2 (aunque la reacción sea favorable energéticamente, ya que el CO2 y el H2O son productos más estables) y ardamos espontáneamente. Un incremento de la temperatura tiene por efecto aumentar la energía cinética media de las moléculas y, por consiguiente, elevar la fracción de ellas cuya energía excede a la de activación; por esta razón, la glucosa arde al aplicar una llama.
La célula debe acelerar selectivamente determinadas reacciones químicas necesarias para su supervivencia, por lo que no puede depender de un método tan inespecífico como el cambio de temperatura. En su lugar, ha desarrollado moléculas capaces de buscar caminos alternativos de la reacción con menor energía de activación; es como si excavasen un “túnel” que atravesara la “colina” de energía, por el que pudieran transitar muchas moléculas de sustrato que carecen de la energía necesaria para ascender hasta la cima. Las moléculas que aumentan de este modo la velocidad de reacción, sin alterarse en el proceso, reciben el nombre de catalizadores.
El éxito de los seres vivos se puede atribuir a la capacidad de la célula para fabricar miles de catalizadores distintos, cada uno específico de determinada reacción química. En su mayoría tienen naturaleza proteínica y se conocen como enzimas, aunque también se han descubierto moléculas de ARN catalíticas denominadas ribozimas.
Muchas enzimas poseen un nombre clásico que, generalmente, se forma añadiendo el sufijo -asa al nombre del sustrato. Así, la sacarasa cataliza la hidrólisis de sacarosa con producción de glucosa y fructosa. Pero a veces el nombre clásico no sigue esta regla —por ejemplo, tripsina o pepsina—, y también se dan casos de enzimas diferentes que tienen el mismo nombre, o de una misma enzima a la que se conoce por dos o más nombres. A causa de estas ambigüedades se ha optado por un nombre sistemático, que identifica el sustrato y el tipo de reacción catalizada. En función de dicha reacción las enzimas se catalogan en seis clases:
- Oxidorreductasas, que intervienen en reacciones en las que se transfieren electrones.
- Transferasas, que catalizan la transferencia de grupos funcionales entre dos moléculas.
- Hidrolasas, que catalizan la ruptura de enlaces por acción del agua.
- Liasas, que rompen dobles enlaces adicionándoles grupos funcionales o, por el contrario, extraen grupos funcionales de determinados sustratos, originando en estos dobles enlaces o anillos.
- Isomerasas, que transfieren grupos dentro de una molécula para originar isómeros.
- Ligasas o sintetasas, que catalizan la formación de enlaces C–C, C–O, C–S y C–N entre dos moléculas mediante reacciones de condensación, gracias a la energía del ATP.
Obra publicada con Licencia Creative Commons Reconocimiento No comercial Compartir igual 4.0
